中国科学技术大学 - 《中国科大报》
中国科大揭示毒素多肽结合并抑制hASIC1a离子通道的结构机制
2020-09-25
浏览(233) (0)
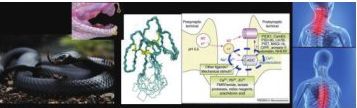
本报讯 9月11日,中国科大田长麟课题组与清华大学刘磊课题组合作,应用冷冻电镜技术解析了首 个 人 源 酸 敏 感 离 子 通 道hASIC1a,以及 hASIC1a 与Mambalgin1 复合物的冷冻电镜结构,并综合应用19F-NMR,膜片钳电生理功能分析等技术,揭示了毒素多肽结合并抑制hASIC1a离子通道的结构机制。其成果发表在eLife杂志。
2012年,法国研究人员从黑曼巴蛇毒液中分离出来两种多肽物质“Mambalgins”,可以止疼,具有药物开发价值。2014年,田长麟实验室运用蛋白质化学合成技术成功制备了具有生物活性的 Mambalgin1 毒素,并应用液体NMR方法解析了Mambalgin毒素的溶液结构。
hASIC1a/Mambalgin1 复 合 物结构表明该毒素多肽通过静电相互作用及疏水作用结合在hASIC1a蛋白胞外结构域的外侧,修正了前人对于该毒素与ASIC通道相互作用方式的假说。进一步研究表明,Mambalgin1 选择性结合处于关闭状态的ASIC通道,并将离子通道锁定在关闭构像。据此,作者提出了Mambalgin1 毒素通过一种状态锁定机制实现抑制ASIC通道活性。这一新机制的提出,将为靶向hASIC1a的创新多肽药物开发提供有价值的线索。
研究发现来源于人ASIC通道与来源于鸡的ASIC通道在整体结构上高度相似,但hASIC1a与cASIC1特定位点上氨基酸的差异导致Mambalgin1 分别对 hASIC1a 或cASIC1 的抑制效果差异,揭示了Mambalgin1毒素多肽对不同物种间调节作用效果差异的物理化学基础。
本工作由我校特任副研究员孙德猛,刘三玲,博士生李思宇,张梦鸽等共同完成。田长麟、张隆华、刘磊为共同通讯作者。(微宗)